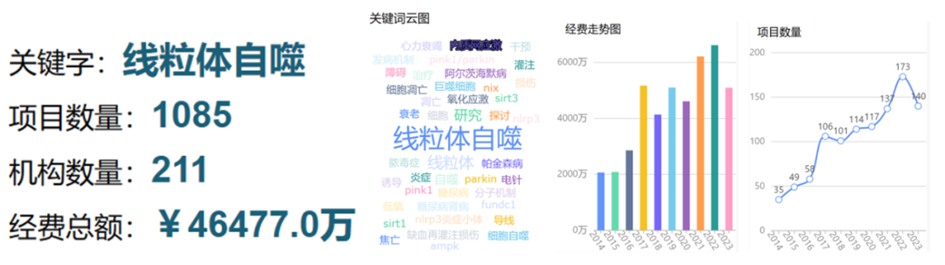
今天我们所谈的主题是这几年热度高居不下的线粒体自噬(mitophagy),截至目前,有关线粒体自噬的中标数已经超过了1000项,累积的科研经费资助超4个亿,且近几年的项目数量均维持在100项以上。
图片来源:www.citexs.com
今天我们就从这篇发表于Signal Transduction and Targeted Therapy(IF 39.3)上题为“The mitophagy pathway and its implications in human diseases”的文章,一起认识一下研究日益白热化的线粒体自噬(mitophagy)。

图片来源:https://pubmed.ncbi.nlm.nih.gov/37582956/
01线粒体自噬相关的里程碑式发现
Lemasters于2005年首次提出线粒体自噬,并指出线粒体损伤是启动线粒体自噬的信号。帕金森蛋白2(Parkin)在诱导线粒体损伤时,被招募到线粒体中去极化,促进线粒体自噬降解。
随后,研究者在酵母中发现了第一个线粒体自噬受体,即自噬相关蛋白ATG32。此后,大量线粒体自噬受体被发现,包括BNIP3L、FUNDC1、PHB2、MCL-1等(图1)。
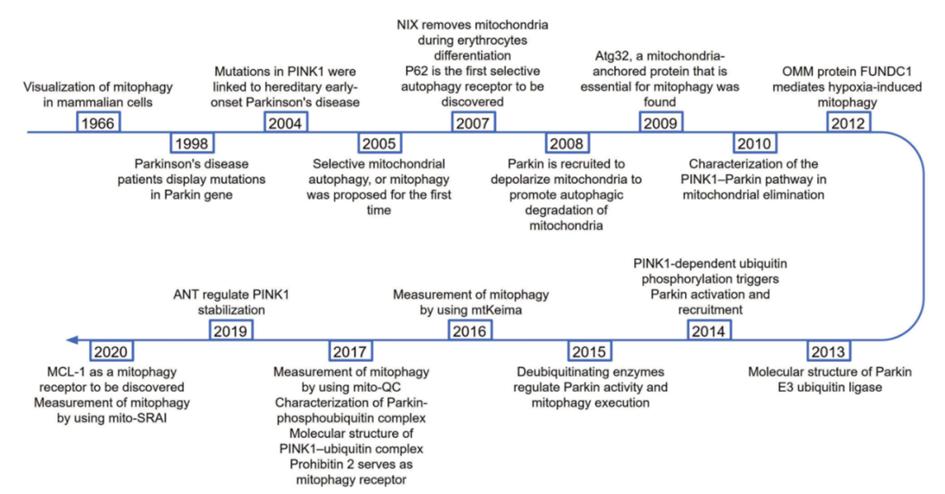
图1:线粒体自噬相关研究中一些关键的时间节点
02线粒体自噬的途径和机制
随着线粒体自噬研究不断的推进,发现了许多线粒体自噬途径,比较经典的为以下两类:
1 PINK1-Parkin介导的线粒体自噬
在PINK1-Parkin调控途径中,泛素链的组装对于线粒体自噬非常重要。其中包含三个关键组件:
· PINK1作为线粒体损伤传感器;
· Parkin作为信号放大器;
· 泛素链作为信号效应器。
它们共同决定受损的线粒体如何激活线粒体自噬(图2)。
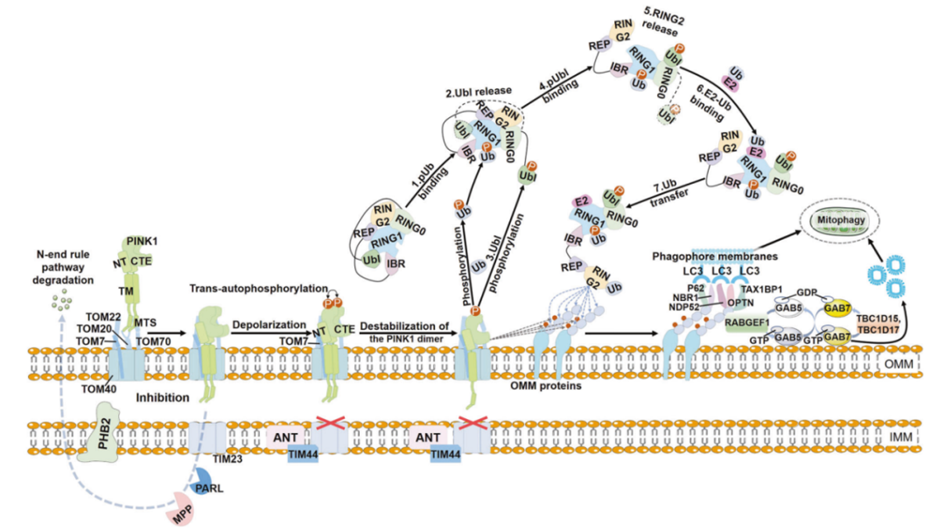
图2:PINK1-Parkin介导的线粒体自噬示意图
2 PINK1-Parkin非依赖性线粒体自噬
当发生缺氧或线粒体膜电位丧失等情况时,BNIP3会抑制Opa1并促进Drp1的活性,导致线粒体断裂和受损线粒体的分离。同时,BNIP3还会将Parkin招募到线粒体上,激活线粒体自噬。NIX是Parkin的底物,被Parkin泛素化后,NIX会招募NBR1到线粒体上,通过线粒体自噬降解受损的线粒体(图3)。
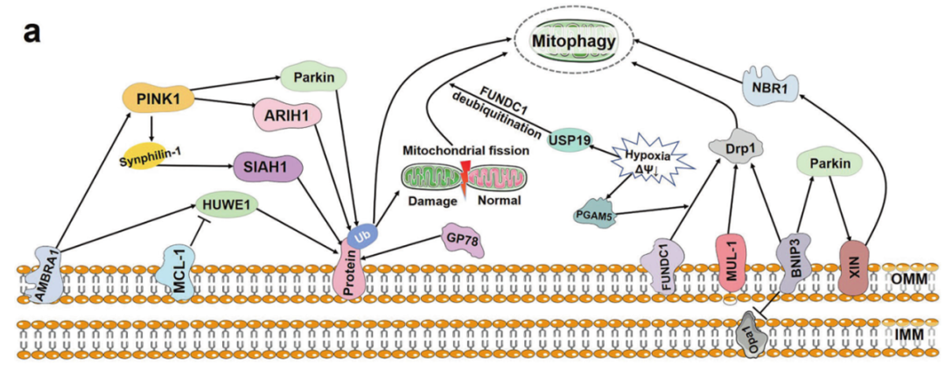
图3:PINK1-Parkin非依赖性线粒体自噬示意图
03生物发生和自噬共同维持线粒体稳态
受损的线粒体可能引起不对称的裂变,形成两个具有不同膜电位的子线粒体,其中一个去极化,另一个完全极化。去极化的线粒体会通过线粒体自噬被清除,以确保正常功能的线粒体得以保留。
然而,线粒体自噬也会导致线粒体数量减少,进而减少向细胞提供的能量。适时激活线粒体生物发生是维持线粒体稳态的关键,其平衡与AMP/ATP和NAD+/NADH比率的增加有关。
04线粒体自噬与疾病
由于线粒体是细胞中的基本组成成分,涉及全身各个系统的疾病,其中比较热门的就是肿瘤和衰老领域。
在许多肿瘤细胞中可以检测到Parkin的缺失或突变,这会导致线粒体自噬缺陷和线粒体ROS水平升高。ROS可以稳定HIF-1α并激活糖酵解,进而加速肿瘤进展。
在衰老过程中,线粒体的结构和功能发生广泛的变化,产生的ROS无法被有效清除,导致线粒体功能障碍。线粒体自噬从青春期到成年有所增加,然后在老年动物中急剧减少。
高分文章
由于线粒体功能障碍是许多疾病的根源,因此线粒体自噬目前是一个快速发展的领域。近年来,在了解线粒体自噬在什么特定条件下以及如何在细胞基础上被激活方面取得了显著进展。有关这些方面的研究,我们为大家推荐几篇可参考思路的高分文章。
§ 这篇发表在Immunity的文章,发现了线粒体自噬可以诱导T记忆干细胞的抗肿瘤能力。

§ 这篇发表在Cancer Research杂志上的文章,揭示了线粒体自噬可以促进氧化磷酸化,并进一步诱导肿瘤细胞的耐药性。

国自然中标题目
近年来与线粒体自噬相关的部分中标项目也整理好在这里,供大家参考:

国自然思路
一个好的研究,应该从基础研究出发,探究线粒体功能及其调控机制等科学问题,并将这些基础研究成果应用于实际问题的解决。但是基础应该怎么做,转化又应该怎么走,以下小编就抛砖引玉,谈谈自己的拙见。
基础研究
§ 线粒体自噬的调控机制:深入研究线粒体自噬的复杂调控机制,包括不同途径之间的相互作用、替代性和功能冗余。了解线粒体自噬在代谢状态、应激条件和组织发育阶段的变化,以揭示其多样性和灵活性。
§ 时空调控规律:研究不同生理和病理条件下,不同线粒体自噬受体的时空调控规律。这包括了解线粒体自噬在细胞内的分布、活性及其与其他细胞生理过程的交互作用。
§ 疾病模型研究:利用缺乏单个或多个线粒体自噬受体的生物体,结合不同的条件刺激,以及与遗传疾病模型的交叉研究,揭示特定途径在生理或病理条件下的作用。
§ 活体组织研究:随着荧光报告探针在体内模型的发展,研究活体组织中的线粒体自噬。使用不同的模型提供不同的视角,探索线粒体自噬的机制。
转化研究
§ 药物开发:研究线粒体自噬调节因子,尤其是新的调控因子,为开发新型、高效的靶向药物提供基础。借助人工智能等技术,进行有针对性的药物设计。
§ 体外诱导线粒体自噬:探索体外诱导线粒体自噬的新方法,克服目前使用的线粒体解偶联剂或线粒体毒素的局限性。研发更可控、精准的体外诱导方法。
§ 临床疗效评估:对已有的线粒体自噬调节剂进行更深入的临床疗效评估,了解其在治疗疾病方面的实际效果和潜在局限。
§ 结合新技术:利用新技术如人工智能,挖掘线粒体自噬的潜在调控因子,基于天然产物的发现,以更好地理解线粒体自噬的机制和寻找新的治疗靶点。













